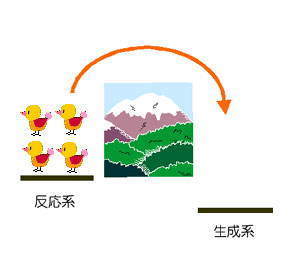
| 反応の開始時 |
|
高いエネルギーを持った一部の分子が反応して、 反応系から生成系への物質の移動が起こり始める。 反応速度(各成分の量の時間的変化)は、反応の起こりやすさの目安である反応速度定数kと各成分の濃度Cのべき乗の積で表される。 v = kCAαCBβ... |
|
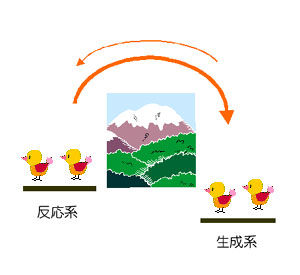
| 過渡期 |
|
生成系の成分の量が増し,生成系から反応系への物質の移動速度(左向き)も大きくなる。 しかし,まだ反応系から生成系への物質の移動速度(右向き)の方が大きいため、生成系の成分の量は増加する。 |
|
|
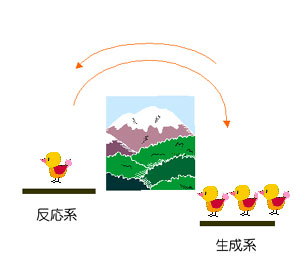
平衡状態 |
|
反応系に比べて生成系の方が安定なので、生成系の物質の割合のほうが多くなる。その結果 反応系から生成系への物質の移動速度(右向き)は減少し,生成系から反応系への物質の移動速度(左向き)が増す。ついには,反応系から生成系への物質の移動速度(右向き)と釣り合って,見かけ上物質の移動が無いように見える。 生成系の反応速度(物質の移動速度) =生成系の反応速度定数×生成系の濃度 |
このページの著作権は,木原 寛が保有しています。