![]()
燃焼という現象は、「自己維持型」の反応です。つまり、自分の力で反応を維持してゆかなければならないということです。
そのためには、反応進行中に熱を次々と発生して、温度をある値以上に保つ必要があるわけです。
発火が起こるための第一条件は、まず発火に至る化学反応が発熱過程でなければならないということです。
化学反応はたくさん並行して起こり、それぞれの段階は発熱または吸熱の反応ですが、燃焼が起こるため
には、全体として「発熱」でなければなりません。
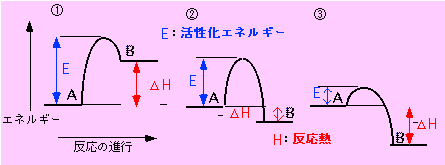
状態Aと状態Bのエネルギー(エンタルピー)の差を、反応熱(図中のΔH)といいます。
① A < B ΔH < 0 吸熱反応 ② A > B ΔH > 0 発熱反応 ③ A > B ΔH > 0 発熱反応
化学反応(状態Aから状態Bへの変化)が起こるためには、ある高さのエネルギーの山(障壁)を越えなければなりません。
この山の高さを活性化エネルギー(図中のE)といいます。
発熱反応で得られる熱エネルギーは、反応熱と単位時間あたりの反応量を掛けたものになります。
したがって、化学反応を起こす分子の数が増え、まわりに奪われる量を上回るエネルギーが生み出されなければ、
燃焼に必要な温度を得ることはできません。
そのためには、次の二つのどちらかが必要になります。
活性化エネルギーと反応速度 の項もご参照ください。
このページの著作権は,木原 寛と今福京子が保有しています。